Dinh dưỡng và loãng xương: Giới thiệu
21/04/2019
Loãng xương là một vấn đề đang được thế giới rất quan tâm vì qui mô lớn và hệ quả nghiêm trọng của nó trong cộng đồng. Loãng xương là một bệnh phức tạp, nguyên nhân của bệnh vẫn chưa được xác định rõ ràng.
Loãng xương là một vấn đề đang được thế giới rất quan tâm vì qui mô lớn và hệ quả nghiêm trọng của nó trong cộng đồng. Loãng xương là một bệnh phức tạp, nguyên nhân của bệnh vẫn chưa được xác định rõ ràng. Tuy nhiên, nhiều nghiên cứu trong thời gian qua đã phát hiện một số yếu tố nguy cơ có liên quan đến bệnh và những yếu tố này có thể chia thành 4 nhóm chính: mật độ chất khoáng trong xương, hormone, di truyền, lối sống và dinh dưỡng. Trong đó, chế độ dinh dưỡng là một yếu tố quan trọng và có thể thay đổi được. Nhưng cũng giống như các bệnh có liên quan đến chế độ ăn uống khác, đây là một mắc xích không đặc hiệu. Không những thế, việc đánh giá lợi ích của một chế độ dinh dưỡng vốn ảnh hưởng đến toàn thân lên một cơ quan hoặc một bệnh lý riêng biệt rất khó khăn. Ngoài ra, nghiên cứu dịch tễ học về mối liên quan giữa chế độ ăn với một bệnh nào đó, cũng lại không thể có được một số liệu về chế độ ăn đáng tin cậy, cũng như có thể tiêu biểu cho chế độ ăn thực sự của cá nhân đó. Do đó, đại đa số khi nói đến chế độ dinh dưỡng, thực ra là nói đến thành tố dinh dưỡng (nutrient), một hình thức gián tiếp đánh giá chế độ ăn uống. Ngay cả việc đánh giá thành tố dinh dưỡng trong một chế độ ăn cũng không đơn giản, vì thành tố dinh dưỡng có mặt trong các thức ăn khác nhau với hàm lượng và mật độ khác nhau; khâu chế biến thức ăn cũng làm thay đổi đáng kể lượng thành tố dinh dưỡng có thể được hấp thu. Do đó, cho đến hiện nay vẫn chưa có một khuyến cáo về một chế độ ăn hoặc thành tố dinh dưỡng đặc hiệu nào có thể phòng ngừa hoặc điệu trị loãng xương. Tuy nhiên, từ rất lâu, hai thành tố luôn đã được thừa nhận là có lợi cho sức khoẻ xương, bao gồm calcium và vitamin D.
Mật độ xương ở một cá nhân là kết quả của hai thông số sinh học: mật độ xương đỉnh (peak bone mineral density) đạt được khi ở độ tuổi 20-30, và tỷ lệ mất xương sau giai đoạn trưởng thành (Hình 1).
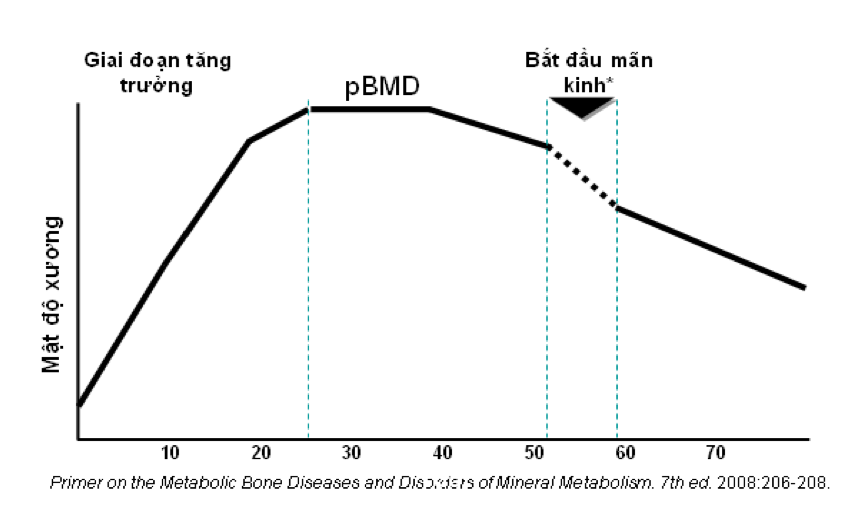
Hình 1. Thay đổi mật độ xương theo độ tuổi.
Calcium và vitamin D ảnh hưởng đến cả hai thông số này. Trong đó, vitamin D cần thiết cho sự hấp thu calcium, làm giảm nồng độ PTH (parathyroid hormon) trong huyết thanh, giúp giảm huy động calcium từ xương, và giảm mất xương [1]. Cùng với một số thành tố khác, cung cấp calcium đầy đủ ở giai đoạn phát triển, sẽ giúp cá nhân đạt được mật độ xương đỉnh tối đa. Đồng thời, duy trì cung cấp calcium - vitamin D đầy đủ sau tuổi trưởng thành giúp giảm được tốc độ mất xương, đặc biệt ở phụ nữ sau mãn kinh và người già.
Vai trò của calcium
Calcium, khoáng chất phong phú nhất trong cơ thể, được tìm thấy trong một số thực phẩm và dinh dưỡng là nguồn cung cấp calcium tự nhiên. Lượng calcium trong cơ thể được phân phối chủ yếu tại 3 vị trí [2], gồm:
· Trong xương và răng: chiếm tới 99% lượng calcium trong cơ thể, calcium ở dưới dạng tinh thể và gắn chặt và khung chất nền collagen của xương. Do vậy sự trao đổi calcium giữa xương và các khoang khác trong cơ thể rất hạn chế, chỉ ~ 0,1% tổng lượng calcium của xương [2] (Hình 2) được thay đổi mỗi ngày thông qua quá trình hủy và tạo xương.
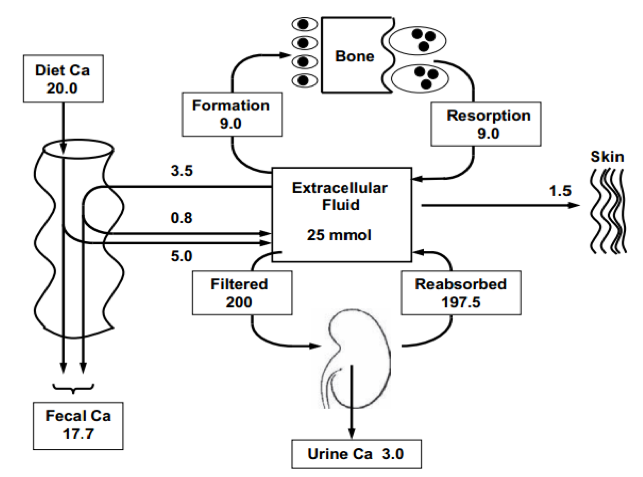
Hình 2. Input và output của calcium . Nguồn Heanay RP, 2004
· Trong tế bào: đóng vai trò chất đưa tin, nối kết những tín hiệu ngoại bào với các cơ chế đáp ứng nội bào. Lượng calcium nội bào thấp và thường gắn với protein giúp tích trữ calcium trong tế bào (như sequestrin, parvalbumin, calbindin…). Sự trao đổi calcium nội và ngoại bào rất hạn chế, giúp nồng độ calcium nội bào không bị ảnh hưởng bởi lượng calcium dịch ngoại bào.
· Trong dịch ngoài bào và máu: mặc dù chỉ chiếm ~ 1% tổng lượng calcium cơ thể, nhưng lượng calcium này cần thiết cho nhiều chức năng quan trọng như co dãn mạch máu, co cơ, truyền tải xung lực thần kinh và điều hoà nhịp tim [3]. Nồng độ calcium trong huyết thanh được ổn định, không dao động theo lượng calcium trong chế độ ăn nhờ vào hệ đệm của xương.
Tại ruột, calcium được hấp thu vào máu theo 2 đường:
· Thụ động ở cạnh tế bào (paracellular) thông qua các mối nối chặt chẽ giữa các tế bào niêm mạc, theo gradient nồng độ calcium
· Chủ động ở bờ bàn chải của tế bào niêm mạc(transcellular), nhờ các kênh ion ở màng tế bào (chủ yếu kênh TRPV6), sau đó được gắn kết với calbindin D9K, một protein được tổng hợp nhờ vào sự hiện diện của vitamin D, và được bơm vào máu qua bơm PMCA1b (Hình 2).
Trong cả 2 quá trình này, sự hấp thu calcium đạt tối ưu khi calcium ở dạng ion hòa tan, và quá trình hình thành ion Ca21 này chịu sự tác động của các chất khác có trong dinh dưỡng, như một số protein có trong sữa mẹ giúp tăng khả dụng sinh học (bioavailability) giúp tăng hấp thu calcium. Khi chế độ ăn giàu calcium, con đường thụ động paracellular chiếm ưu thế. Ngược lại, khi chế độ ăn thiếu calcium, con đường chủ động transcellular phụ thuộc vitamin D đóng vai trò quan trọng trong sự hấp thụ calcium.
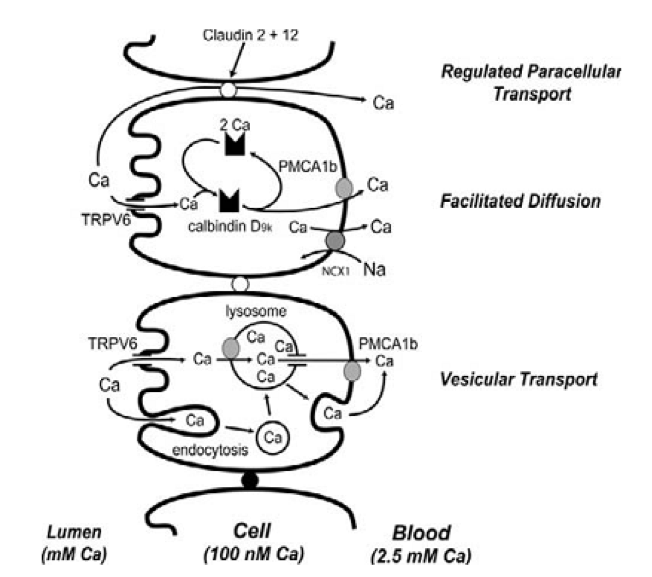
Hình 3. Hấp thu calcium ở ruột. Nguồn
. Hấp thụ calcium xảy ra chủ yếu ở tá tràng, chỉ một lượng nhỏ calcium được hấp thu ở hồi tràng và đại tràng, thường < 10% tổng lượng calcium được hấp thu (Hình 4).

Hình 4. Sự hấp thu calcium tại các vị trí ở đường ruột. Nguồn:
Sơ đồ trong hình 1 cho thấy lượng calcium cung cấp cho cơ thể (input) chủ yếu qua thực phẩm, và được thải ra (output) qua 3 đường: thận, tiêu hóa và da, trong đó thận đóng vai trò quan trọng. Chỉ khoảng 30% lượng calcium trong thức ăn được hấp thu, quá trình hấp thu này chịu ảnh hưởng của một số yếu tố, như:
· Lượng calcium trong thực phẩm: nồng độ calcium càng cao, hiệu quả sự hấp thu càng giảm [3], do đó rất khó ngộ độc calcium nếu dùng đường uống.
· Tuổi tác: tổng lượng calcium được hấp thu khoảng 60% ở trẻ em [3, 4], nhưng sẽ giảm dần theo độ tuổi còn khoảng 20-30% ở người lớn.
· Vitamin D intake: bao gồm tiếp xúc với ánh nắng mặt trời và trong thực phẩm. Sự hấp thu calcium tốt nhất khi nồng dộ 25(OH)D trong máu > 30ng/ml.
· Thành phần thực phẩm: phytic acid và oxalic acid có trong thực vật làm giảm hấp thu calcium.
Một lượng lớn calcium sẽ được đào thải ra ngoài qua đường niệu, tiêu hóa và mồ hôi. Quá trình đào thải này chịu ảnh hưởng của nhiều yếu tố, như:
· Sodium và protein: ăn nhiều sodium sẽ làm tăng thải calcium qua đường niệu [5, 6]. Ảnh hưởng của protein lên hấp thu calcium còn tranh cãi, một số nghiên cứu cho thấy chế độ ăn giàu protein động vật sẽ gây tình trạng toan hóa và tăng bài tiết calcium qua đường niệu [5, 6], nhưng nghiên cứu mới đây lại cho thấy protein cũng làm tăng hấp thu calcium ở đường ruột, nên protein không ảnh hưởng nhiều đến tổng lượng calcium trong cơ thể [7].
· Cà phê và trà: chất caffeine có trong cà phê và trà làm giảm hấp thu và tăng bài tiết calcium [8]. Tuy nhiên nếu chỉ uống 1 tách cà phê hoặc 2 ly trà/ ngày thì chưa ảnh hưởng đến xương [9].
· Rượu: ảnh hưởng đến chuyển hóa calcium thông qua làm giảm hấp thu calcium, và ức chế men 25-OHase ở gan khiến không tổng hợp được 25(OH)D tại gan [10]. Tuy nhiên lượng rượu là bao nhiêu để gây được ảnh hưởng như trên thì chưa rõ.
. .
Cơ thể hấp thụ calcium cho nhu cầu cần thiết bằng hai cách. Một là từ thức ăn có chứa calcium, hoặc bằng cách uống calcium bổ sung. Các nghiên cứu phân tích tổng hợp trên người trẻ cho thấy bổ sung calcium với hàm lượng từ 300-1200mg/ ngày, bằng nhiều chế phẩm khác nhau (calcium citrate, calcium carbonate, calcium phosphate, calcium gluconate) có hiệu quả làm tăng khối lượng xương [11-15], nhưng mức độ ảnh hưởng chỉ khoảng 1%, và tác dụng này có thể kéo dài ngay khi đã ngưng bổ sung calcium. Hiệu quả này cũng được ghi nhận với các nghiên cứu lâm sàng đối chứng ngẫu nhiên [16-18], tuy nhiên mức độ ảnh hưởng phụ thuộc vào vị trí xương, độ tuổi can thiệp và hàm lượng calcium bổ sung. Nhưng ở phụ nữ sau mãn kinh trong vòng 5 nặm, bổ sung calcium không có hiệu quả hay chỉ có hiệu quả tối thiểu đến phòng chống mất xương [19-22], có lẽ trong thời gian này, ảnh hưởng của tình trạng thiếu hụt estrogen và các thay đổi nội tiết tố khác có phần trội hơn là ảnh hưởng của calcium. Và ở đối tượng phụ nữ già hơn, bổ sung calcium làm tăng mật độ xương 1-3% so với nhóm chứng [22-26], đồng thời một nghiên cứu tổng hợp các nghiên cứu lâm sàng đối chứng ngẫu nhiên cho thấy ở phụ nữ sau mãn kinh, calcium có thể làm giảm tỉ lệ mất xương khoảng 2% mỗi năm [27].
Trong khi một nghiên cứu tổng hợp ở phụ nữ sau mãn kinh, nhằm mục đích đánh giá hiệu quả của bổ sung calcium trong phòng ngừa gãy xương do loãng xương, cho thấy tăng liều bổ sung calcium làm giảm được nguy cơ gãy xương đùi [28], và một số nghiên cứu quan sát khác cho thấy phụ nữ có lượng hấp thu calcium thấp, sẽ tăng nguy cơ gãy xương đùi [29, 30] ; thì một số các nghiên cứu case-control và cohort ghi nhận không có mối liên hệ giữa bổ sung calcium và nguy cơ gãy xương đùi ở phụ nữ sau mãn kinh [31-35], đồng thời các nghiên cứu khảo sát mối liên quan giữa cung cấp calcium và gãy xương do loãng xương, cũng không tìm thấy ảnh hưởng, hoặc calcium chỉ giảm đựơc rất ít tần suất gãy xương mới [23, 26, 36-38].
Cơ chế tác dụng có lợi của calcium trên sức khỏe xương có lẽ do đặc điểm làm giảm quá trình huỷ xương của calcium. Ngoài ra, nghiên cứu còn cho thấy calcium làm giảm chu chuyển xương, phản ánh qua nồng độ marker tạo xương giảm sau khi bổ sung calcium ở trẻ em [16, 39-42], đồng thời, bổ sung calicium ở nữ trước tuổi trưởng thành có hiệu quả làm tăng chiều dài xương, điều này cho thấy không chỉ ảnh hưởng đến quá trình remodeling, calcium còn ảnh hưởng tích cực đến cả quá trình modeling [16, 19, 41, 43].
Nếu như nghiên cứu ghi nhận liệu pháp bổ sung calcium có tác dụng tích cực cho sức khoẻ xương, thì các nghiên cứu gần đây cho thấy duy trì lượng calcium đầy đủ qua ăn uống với các thực phẩm giàu calcium là một biện pháp hữu hiệu cho việc ngăn ngừa calcium di chuyển khỏi xương, điều này được ghi nhận qua các nghiên cứu quan sát cũng như đối chứng lâm sàng ngẫu nhiên. Ở trẻ em, nếu không đươc uống sữa dài hạn, sẽ bị giảm khối lượng xương ở tất cả các vị trí [44-50] ; ngoài ra, uống sữa ít ở giai đoạn sớm của cuộc đời ( thiếu nhi, thiếu niên), sẽ làm tăng nguy cơ gãy xương sau đó [14, 51]. Tiêu thụ lượng lớn sữa và chế phẩm của sữa giúp tăng kích thước vỏ xương [52] cho thấy sữa có tác dụng tích cực đến quá trình modeling. Nghiên cứu trên phụ nữ sau mãn kinh ghi nhận khi tiêu thụ thực phẩm giàu calcium kèm theo vitamin D có hiệu quả giảm marker huỷ xương, giảm mất xương và tăng mật độ xương [53-56].
Nghiên cứu nhằm so sánh hiệu quả giữa cung cấp calcium qua thực phẩm và bổ sung calcium bằng viên nén tổng hợp, Cheng et al tìm thấy tiêu thụ bơ giúp tăng kích thước vỏ xương tốt hơn là bổ sung viên nén calcium cùng liều lượng [57]. Điều này một lần nữa khẳng định tầm quan trọng của việc duy trì lượng calcium đầy đủ trong trong thức ăn để bảo vệ sức khoẻ xương. Vấn đề đặt ra là cung cấp calcium hàm lượng như thế nào là đủ cho xương phát triển ? Theo khuyến cáo của Viện Y tế Hoa kỳ, nhu cầu calcium cần thiết hàng ngày được trình bày trong bảng sau:
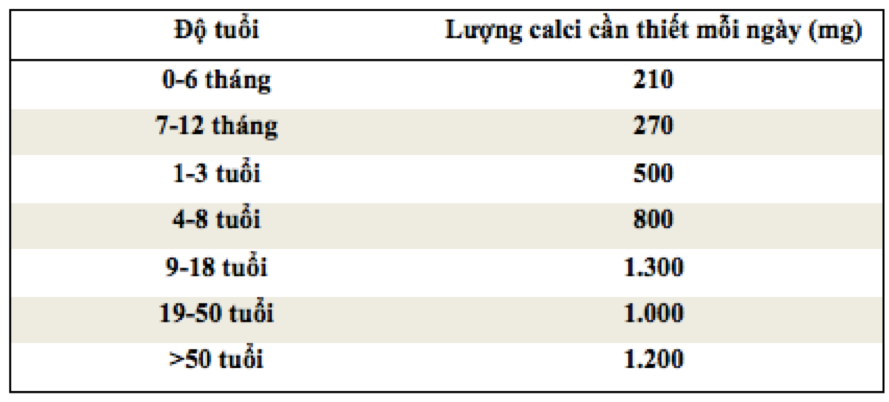
Bảng 1. Lượng calcium cần thiết để duy trì xương khoẻ mạnh
Trong đó, lượng calcium tối đa an toàn là 2500mg/ ngày, nếu dùng lượng calcium nhiều hơn chẳng những không thu được tác dụng tốt hơn trong việc bảo vệ xương, mà còn có thể làm tăng nguy cơ sỏi đường niệu. Đồng thời để thuận tiện cho việc tính toán lượng calcium tiêu thụ cho người tiêu dùng, Hiệp hội thực phẩm và thuốc Hoa kỳ ( The Food and Drugs Administration FDA) đã đưa ra khái niệm “Percent Daily Value” (%DV: % nhu cầu hàng ngày) với 100%DV=1000mg cacium, ví dụ một thực phẩm có thành phần calcium là 20%DV, có nghĩa trong thưc phẩm đó có 20%x1000mg=200mg calcium. Một số thưc phẩm giàu calcium có %DV như bảng sau:
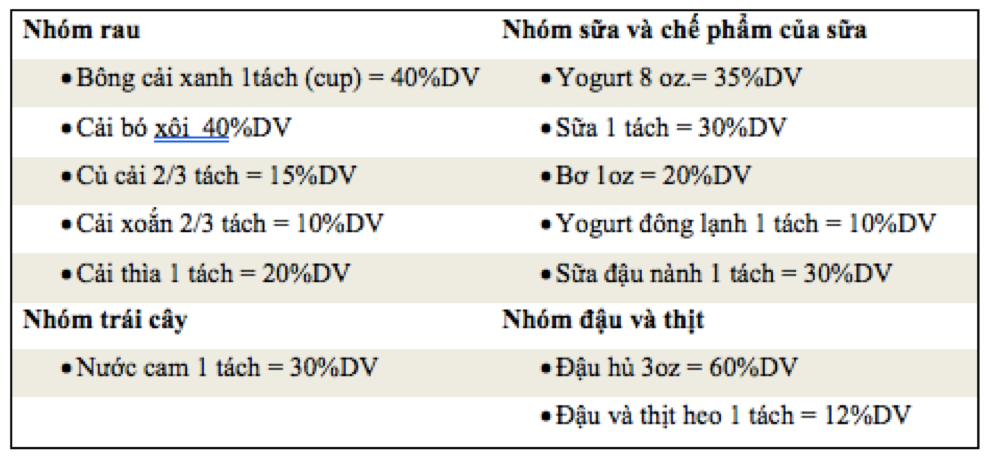
Bảng 2. Thành phần calcium trong một số thực phẩm
Ghi chú : 1 oz. = 1 ounce = 28,35g
Nghiên cứu của chúng tôi trên phụ nữ Việt nam sau mãn kinh cho thấy mức tiêu thụ calcium trung bình chỉ có 683mg/ngày, rất thấp so với nhu cầu cần thiết tối thiểu là 1000mg/ ngày [58]. Vì vậy, để nâng cao sức khỏe của xương, cần chú ý tăng cường lượng thức ăn hàng ngày bằng những thực phẩm giàu calcium , như sữa và chế phẩm của sữa, tôm, cua, tép (nhất là tôm, cua đồng), ốc, lòng đỏ trứng, rau dền, rau đay, rau mồng tơi, rau ngót, đậu nành, vừng…Đối với những người không thể hấp thu được sữa do thiếu men lactasae, có thể dùng các chế phẩm của sữa chứa ít lactose hơn như bơ, yogurt, đồng thời kèm với các thực phẩm giàu calcium khác như rau xanh, đậu nành. Nếu không ăn đủ calci trong chế độ ăn, cần bổ sung viên calcium. Hai dạng chính thường dùng để bổ sung calcium là citrate và carbonate. Do sự hấp thu của các muối calcium này phụ thuộc vào acid của dạ dày, nên calcium carbonate hấp thu tốt nhất khi dùng kèm với thức ăn trong khi calcium citrate có thể dùng có hoặc không có thức ăn [59]. Calcium citrate cũng được chon lựa khi người bệnh có vấn đề về đường tiêu hóa như thiếu acid (achlorhydria, viêm đường ruột hoặc rối loạn hấp thu [3]. Các dạng calcium khác cũng được dùng trong viên bổ sung và trong thực phẩm gồm gluconate, lactate và phosphate. Thuốc bổ sung calcium được hấp thu tốt hơn ở liều nhỏ (≤ 500mg), chia nhiều lần trong ngày [3]. Tác dụng phụ có thể gặp khi dùng viên bổ sung calcium bao gồm đầy hơi, táo bón, các tác dụng phụ này xảy ra khi dùng calcium carbonate nhiều hơn là dạng citrate [3].
Mỗi cá nhân cần đạt được đủ lượng calcium hàng ngày (ít nhất là 1.200 mg/ ngày, bao gồm cả việc bổ sung nếu cần thiết). Duy trì đủ lượng calcium suốt đời rất cần thiết cho việc đạt được mật độ xương đỉnh, và duy trì xương sau đó. Khoảng 99% calcium được dự trữ trong xương, khi lượng calcium hấp thu không đủ, calcium sẽ “bài tiết” từ xương vào máu để duy trì nồng độ calcium trong máu ở mức ổn định định. Hệ quả là dẫn đến lực xương bị suy giảm và tăng nguy cơ gãy xương. Các tổ chức khoa học quốc tế khuyến cáo rằng đối với phụ nữ trên 50 tuổi, lượng calcium tối thiểu cần thiết hàng ngày là 1.200 mg [60]. Lượng calcium hàng ngày không nên vượt quá 1.200 đến 1.500mg, vì có thể làm tăng nguy cơ sỏi thận và bệnh lý tim mạch.
Bảng 3 minh họa một phương pháp đơn giản để ước tính lượng calcium trong một bữa ăn của một cá nhân. Nam và nữ trên 50 tuổi cần ăn uống khoảng 600 -700 mg calcium/bữa ăn hàng ngày. Việc gia tăng lượng calcium hàng ngày qua thực phẩm là lựa chọn ưu tiên, tuy nhiên bổ sung calcium bằng thuốc viên cũng có thể là một lựa chọn khác nếu chế độ ăn uống thiếu calcium.

Bảng 3. Đánh giá lượng calcium trong bữa ăn hàng ngày
Vai trò của vitamin D
Tuy tên gọi là “vitamin”, nhưng vitamin D không phải là một sinh tố như các sinh tố thông thường (như vitamin A, B, C) vốn hiện diện trong các thực phẩm. Vitamin D thực chất là một loại hormone, hay nói chính xác hơn là một loại tiền hormone. Tính chất hormone của vitamin D còn được minh chứng qua cấu trúc phân tử của vitamin D giống với các hormones trong nhóm steroid như estradiol, corticol, và aldosterone.
Thuật ngữ “Vitamin D” thật ra bao gồm hai loại vitamin có tên là Cholecalciferol (còn gọi là vitamin D3) và Ergocalciferol (vitamin D2). Vitamin D3 được sản sinh chủ yếu từ ánh nắng mặt trời. Ngoài ra, vitamin D còn có thể sản xuất bằng qui trình công nghệ chiết chất 7-dehydrocholesterol từ chất béo của sợi len [61]. Vitamin D2 thường được sản xuất bằng qui trình công nghệ chiết chất ergosterol từ men. Ở Mỹ, cả hai vitamin D2 và vitamin D3 còn được hòa trộn vào sữa, bánh mì và một số sinh tố khác được bày bán trên thị trường tiêu thụ [62].
Vitamin D (D2 hay D3) được sản sinh trong da hoặc qua nguồn hấp thu thực phẩm và dự trữ trong các tế bào mỡ. Các tế bào mỡ giúp chuyển vitamin D vào hệ thống tuần hoàn, và sẽ trải qua hai giai đoạn chuyển hóa. Trong giai đoạn thứ nhất, vitamin D hòa nhập với vitamin D binding protein (VDBP) và được protein này vận chuyển đến gan. Ở gan, vitamin D trải qua một qui trình chuyển hóa và sản sinh ra 25-hydroxyvitamin D, thường hay viết tắt là 25(OH)D3. 25(OH)D3 là dạng vitamin D “thụ động”, nhưng được sử dụng như là một thước đo để thẩm định tình trạng thiếu hay thừa vitamin D cho một cá nhân. Trong giai đoạn hai, 25(OH)D được vận chuyển đến thận và chuyển hóa thành 1,25-hydroxyvitamin D (thường viết tắt là 1,25(OH)2D3), dưới tác động của enzyme 1alpha-hydroxylase (1-OHase). 1,25(OH)2D3 là một hormone kích hoạt và phản ứng rất nhạy với các hornones khác như PTH hay 1-OHase và calcium. Hàm lượng vitamin D trong thận chịu sự kiểm soát chặt chẽ của các hormones và yếu tố sinh hóa như PTH, 1-OHase, calcium và phosphorus [61]. Khi nồng độ 1,25(OH)2D3 huyết thanh cao sẽ ức chế họat động của 1-OHase và PTH sẽ kích thích quá trình ức chế này,làm giảm sản xuất 1,25(OH)2D3 (xem Biểu đồ 1).
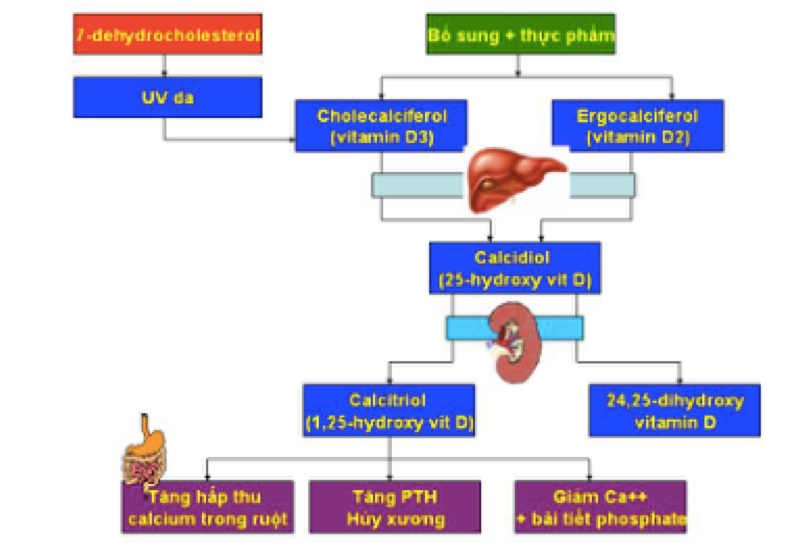
Biều đồ 1. Qui trình chuyển hóa và ảnh hưởng của vitamin D
Ngoài thận, 1-OHase còn có ở các mô và tế bào khác như tế bào hủy xương (osteoclast), da, đại thực bào, bánh nhau, đại tràng, não, tuyến tiền liệt, tế bào nội mô, và tuyến phó giáp [63]. Quy trình sản xuất của 1,25(OH)2D3 dưới tác động của 1-OHase ở mô ngoài thận đón g vai trò quan trọng trong sự tăng trưởng, biệt hóa tế bào và chức năng miễn dịch của cơ thể, những quá trình này xảy ra hoàn toàn độc lập với quá trình chuyển hóa calcium của 1,25(OH)2D3. Nếu 1-OHase ở thận chịu sự điều hòa của PTH, 1-OHase ở mô ngoài thận không đáp ứng với kích thích của PTH, mà thay đổi tùy theo tình trạng sinh lý và bệnh lý của mô.
Vitamin D tương tác với thụ thể vitamin D (VDR hay vitamin D receptor) trong tế bào tạo xương (osteoblasts) và kích họat thụ thể RANKL (receptor activator or Nfĸβ ligand) giống như hormone tuyến cận giáp (PTH) [64]. Do đó, vitamin D điều phối sự hấp thu calcium trong ruột và huy động calcium từ xương. Ngoài các tế bào trong ruột non và tế bào tạo xương, thụ thể VDR còn tìm thấy trong hầu hết các mô trong cơ thể, kể cả não, vú, tim, ruột, và các tế bào miễn dịch. Vitamin D giúp kiểm soát sự tăng trưởng từ các tế bào và kích thích bài tiết insulin và chi phối đến các chức năng của lympocytes và macrophages.
Nhiều nghiên cứu trong vòng 20 năm qua phát hiện rất nhiều mô có hàm chứa thụ thể VDR hay có bằng chứng biểu mô (expression) của vitamin D. Có tất cả 36 mô hàm chứa VDR, và điều này có nghĩa là tế bào trong các mô này có tiềm năng sản sinh ra những phản ứng sinh học, tùy thuộc vào liều lượng của vitamin D trong máu. Các mô này có thể tóm lược trong Bảng 1 dưới đây.
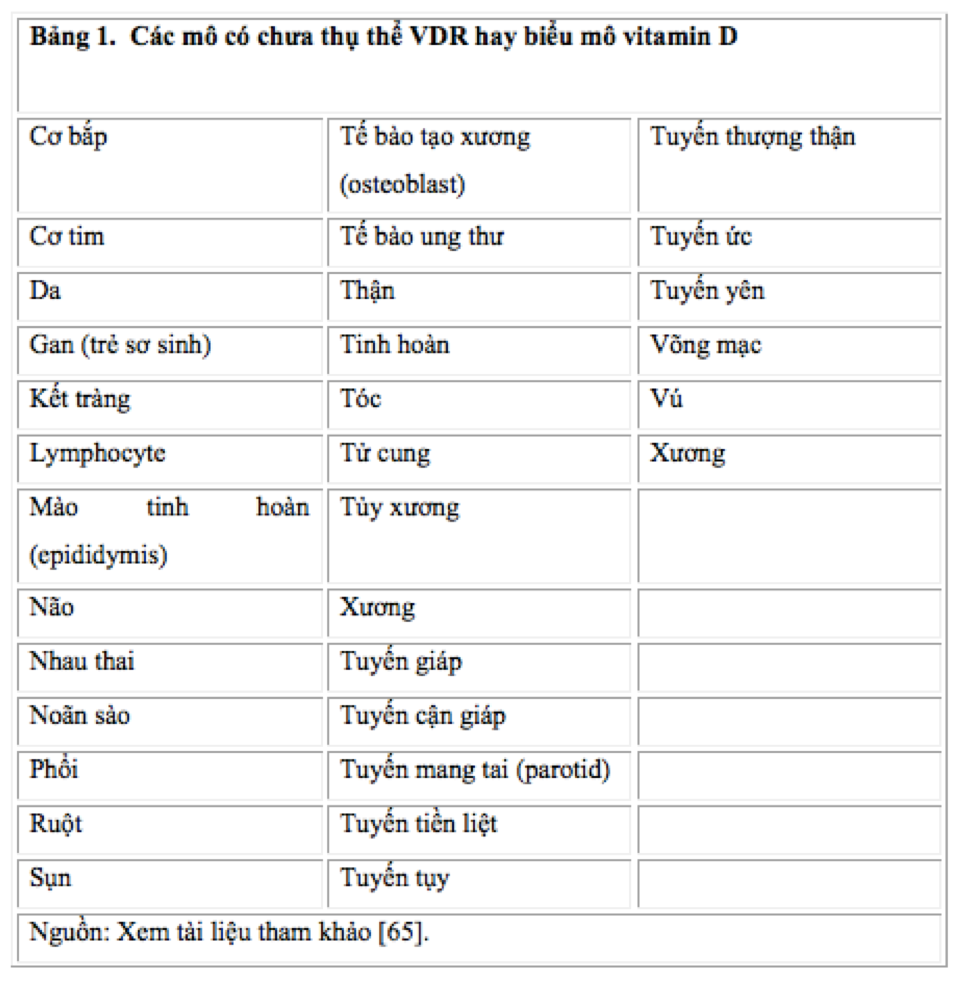
Bảng 1. Các mô có chưa thụ thể VDR hay biểu mô vitamin D
Ảnh hưởng cổ điển của vitamin D là trên các tế bào xương. Thiếu vitamin D gây ra thay đổi huyết động học của calcium và phosphorus, cường phó giáp thứ phát, mất xương, loãng xương và tăng nguy cơ gãy xương. Đối tượng thiếu vitamin D nhẹ thường không triệu chứng nhưng tình trạng này có thể dẫn đến mật độ xương thấp và mất xương, trong khi thiếu vitamin D nặng gây nhuyễn xương.
Nếu thiếu vitamin D, chỉ 15% calcium và 60% phosphorus trong thức ăn được hấp thu [66, 67]. Mối tương tác giữa 1,25(OH)2D3 và thụ thể VDR có chức năng gia tăng hiệu quả hấp thu calcium ở ruột lên 30-40% và phosphorus lên 80% [68]. Một nghiên cứu cho thấy 1,25(OH)2D3 liên quan trực tiếp tới mật độ xương ở người da trắng, da đen và Mỹ gốc Mể Tây Cơ, chỉ đạt được mật độ xương đỉnh tối đa khi nồng độ 25(OH)D cao hơn trên 40ng/ml [69, 70]. Khi 25(OH)D giảm dưới 30 ng/mL, độ hấp thu calcium ở ruột giảm rõ, trong khi hormon phó giáp (parathyroid hormon PTH) tăng cao trong máu [71]. PTH có vai trò kích hoạt các tế bào hủy xương và kích thích các tế bào tiền hủy xương để phát triển thành tế bào hủy xương. Các tế bào hủy xương sẽ phân hủy chất nền collagen gây thiếu xương, loãng xương và tăng nguy cơ gãy xương. Tình trạng thiếu vitamin D và calcium ở thai nhi và trẻ nhỏ có hệ quả ngăn cản sự khoáng hóa calcium ở xương [67]. Khi thiếu vitamin D nặng, PTH bị kích thích tăng tiết, dẫn đến cường phó gíap thứ phát, đồng thời PTH làm mất phospho qua đường niệu, gây mất cân bằng giữa calcium và phospho trong máu và làm giới hạn qui trình khoáng hóa lên chất nền collagen, hậu quả là gây còi xương ở trẻ em và nhuyễn xương ở người lớn [70, 72, 73].
Các nghiên cứu cho thấy bổ sung vitamin D có hoặc không kèm calcium, có hiệu quả làm tăng nồng độ 25(OH)D huyết thanh, cải thiện markers chu chuyển xương và giảm nồng độ PTH [74-76], đồng thời làm tăng mật độ xương [77]. Tuy nhiên, ảnh hưởng của vitamin D đến nguy cơ gãy xương vẫn còn trong vòng tranh cãi. Một nghiên cứu trên 3.270 phụ nữ Pháp cao tuổi được cho uống 1200 mg calcium và 800IU D3 mỗi ngày trong 3 năm cho thấy nguy cơ gãy xương chậu giảm 43% và gãy xương ngoài đốt sống giảm 32% [78]. Giảm 58% nguy cơ gãy xương ngoài đốt sống cũng quan sát thấy trong nghiên cứu trên 389 nam và nữ trên 65 tuổi được uống 500mg calcium và 700IU D3 mỗi ngày [79]. Ngoài ra môt số nghiên cứu khác cho kết quả thấp hơn, như nghiên cứu cho bệnh nhân uống 700-800IU D3 mỗi ngày, ghi nhận giảm nguy cơ gãy xương chậu chỉ 26% và gãy xương ngoài đốt sống 23% [80]. Thậm chí nghiên cứu Women’s Health Initiate so sánh hiệu quả của sử dụng 400IU D3 kèm 1000mg calcium mỗi ngày với placebo trên 36.000 phụ nữ mãn kinh, cho thấy vitamin D không giảm nguy cơ gãy xương mà còn tăng nguy cơ sỏi thận [81]. Nghiên cứu này cũng cho thấy hiệu quả của vitamin D không rõ khi 25(OH)D giảm dưới mức 26 ng/ml, tuy nhiên ở nhóm 25(OH)D < 17ng/mL và sau khi dùng vitamin D 25(OH)D tăng lên >40ng/mL thì hiệu quả của vitamin D thấy rõ. Nghiên cứu RECORD đánh giá hiệu quả của vitamin D khi loại trừ dùng calcium, cho thấy khi dùng đơn độc 800IU D3 mỗi ngày không hiệu quả chống gãy xương, tuy nhiên trong nghiên cứu này 25(OH)D chỉ tăng từ 15,2ng/mL lên 24,8 ng/mL vẫn còn dưới ngưỡng bình thường [82].
Các nghiên cứu đều cho kết quả phối hợp vitamin D và calcium có lợi cho sức khỏe xương, tuy nhiên câu hỏi đặt ra là thành tố nào có vai trò quan trọng. Nhiều nghiên cứu tổng hợp đã được thực hiện nhằm trả lời cho câu hỏi trên, và kết quả ghi nhận được không đồng nhất. Nghiên cứu của Reid cho thấy bổ sung calcium đơn độc làm tăng nguy cơ gãy xương hông, nhưng nguy cơ này giảm khi có phối hợp với bổ sung vitamin D [83]. Ngược lại, một nghiên cứu tổng hợp khác ghi nhận hiệu quả giảm nguy cơ gãy xương của liệu pháp bổ sung calcium, và hiệu quả này giảm ở nhóm dùng kèm với vitamin D [84]. Nhưng tổng kết của Cochran cho thấy bổ sung vitamin D đơn độc không đạt hiệu quả phòng ngừa đựơc gãy xương đùi ở người già, trong khi phối hợp calcium và vitamin D giảm được tỉ lệ phát sinh gãy xương đùi mới (incidence) và và bổ sung vitamin D ở người già thường gây tăng calcium máu, rối loạn tiêu hoá và bệnh thận [85].
Vitamin D được cung cấp hoặc từ thức ăn, hoặc từ tiếp xúc với ánh nắng mặt trời, trong đó nguồn chính 90-95% là từ ánh nắng mặt trời [86]. Vì vậy,không ngạc nhiên khi tỉ lệ thiếu vitamin D ở những xứ lạnh lên đến 80-100% [64]. Tuy nhiên, không chỉ ở xứ lạnh mà ngay cả những vùng nắng nóng quanh năm như Đông Nam Á tỉ lệ này cũng là 30-50% [87], và nghiên cứu của chúng tôi ghi nhận tỉ lệ thiếu vitamin D ở phụ nữ Việt Nam là 46% [88]. Với tình trạng thiếu vitamin D phổ biến như trên, việc cung cấp vitamin D kèm với calcium đầy đủ nhằm bảo vệ sức khỏe xương là cần thiết,và hiện nay, bổ sung calcium-vitamin D được coi là biện pháp căn bản trong điều trị loãng xương và phòng ngừa gãy xương thứ phát. Liều vitamin D được khuyến cáo là 400-800UI/ ngày. Các nghiên cứu cho thấy vào mùa hè chỉ cần phơi nắng trong vòng vài phút, cơ thể đã sản xuất được trung bình 10.000 IU vitamin D. Trong khi đó, thực phẩm chúng ta dùng hàng ngày chứa rất ít vitamin D. Bên cạnh sữa, các loại cá giàu chất dầu như cá hồi, cá tuyết, cá thu, cá trích có lượng vitamin D cao hơn những cá khác. Nấm phơi khô cũng chứa vitamin D. Nhưng sữa, cá và nấm trên đây cũng chỉ cung cấp khoảng 400-500 IU vitamin D tùy vào liều lượng ăn uống. Do đó, ở những vùng nhiệt đới, nên tận dụng nguồn ánh nắng mặt trời làm nguồn cung cấp vitamin D; riêng ở những vùng thiếu ánh nắng, cần bổ sung viên vitamin D.
Lượng vitamin D hàng ngày cần là từ 800 – 1000 IU đối với người trưởng thành và người trên 50 tuổi. Lượng vitamin D này giúp duy trì nồng độ 25(OH)D ở người trưởng thành đạt mức mong muốn là ≥ 30 ng/ml (≥ 75 nmol/L).
Bệnh nhân cao tuổi có nguy cơ thiếu vitamin D bao gồm những bệnh nhân có bệnh lý kém hấp thu (bệnh celiac) và bệnh lý thận mạn, những bệnh nhân ít tiếp xúc với ánh sáng mặt trời. Nồng độ 25(OH)D trong huyết thanh nên được đo đối với các bệnh nhân có nguy cơ thiếu vitamin D và nên bổ sung lượng vitamin D cho các bệnh nhân này.
Nồng độ 25(OH)D đầy đủ được xác định là trên 30 ng/ml (≥ 75 nmol/L). Các bệnh nhân với những bệnh lý kém hấp thu cần bổ sung nhiều hơn. Ở người trưởng thành, ngưỡng giới hạn an toàn cho lượng vitamin D hấp thu là khoảng 2000 IU/ngày, nhưng bằng chứng hiện nay cho thấy với lượng cao hơn 2.000 IU/ngày, thậm chí 10.000IU/ ngày vẫn an toàn [89]. Đối với bệnh nhân cao tuổi, lượng vitamin D tối thiểu là 2.000 IU/ngày để duy trì nồng độ 25(OH)D tối ưu trong cơ thể.
Vai trò của protein
Trong khi calcium và vitamin D được thừa nhận có lợi cho xương, ảnh hưởng của protein đến xương còn trong vòng tranh luận [90],
Một giả thuyết đã tồn tại từ 20 năm qua và được cộng đồng nghiên cứu về loãng xương công nhận nhưng đòi hỏi thêm bằng chứng, là đạm động vật có ảnh hưởng tiêu cực đến sức khỏe xương [91, 92], bởi vì đạm động vật sản sinh một hàm lượng acid nội tố (endogenous acid) lớn từ các acid amin chứa sulfur, cần thiết cho "buffer" từ xương, và do đó gia tăng các quá trình hủy xương [93]. Nếu giả thuyết này đúng thì hàm lượng hấp thu đạm động vật có mối tương quan nghịch với tỷ lệ mất xương. Tuy nhiên, mối tương quan giữa lượng đạm, nhất là đạm động vật, và mật độ xương chưa được chứng minh trong thực tế, và vẫn còn là một đề tài gây ra nhiều tranh luận trong y văn. Các nghiên cứu đều ghi nhận đạm cần thiết cho trẻ em phát triển xương để đạt được mật độ xương đỉnh tối ưu [15, 18, 40, 94]. Nhưng ở người trưởng thành, kết quả không đồng nhất về ảnh hưởng của đạm, cả trên mật độ xương lẫn nguy cơ gãy xương. Một mặt, có nghiên cứu cho thấy người ăn uống nhiều đạm động vật có tỷ lệ gãy xương thấp [95-97], nhưng mặt khác cũng có nghiên cứu cho thấy những người ăn nhiều đạm động vật có tỷ lệ mất xương cao [93] và tăng nguy cơ gãy xương [91, 92, 98]. Về ảnh hưởng trên mật độ xương, một số nghiên cứu cho thấy đạm có tác động tích cực ở người trưởng thành [99, 100], và cả ở phụ nữ sau mãn kinh [101, 102], đồng thời nghiên cứu Framingham ghi nhận tốc độ mất xương ở phụ nữ mãn kinh tỉ lệ nghịch với lượng protein tiêu thụ [103]. Nhưng cũng có những nghiên cứu cho kết quả ngược lại, tiêu thụ lượng đạm cao liên kết với tình trạng giảm mật độ xương [104, 105]. Một nghiên cứu tổng hợp gần đây đánh giá vai trò của protein trên xương, đã cho thấy tiêu thụ quá cao hoặc quá thấp protein đều không có lợi [106], đặc biệt ở nhóm có lượng calcium tiêu thụ <400mg/ ngày. Ngoài ra, nghiên cứu cohort SOF (Study of Osteoporotic Fracture) ghi nhận tốc độ mất xương và tần suất gãy xương đùi cao hơn ở nhóm có tỉ số đạm động vật/ thực vật cao [98].
Cho đến hiện nay, vẫn chưa có một khuyến cáo cụ thể nào về hàm lượng, thành phần cần thiết của thành tố protein với mục đích bảo vệ sức khoẻ xương. Tuy nhiên một số nghiên cứu can thiệp bằng khẩu phần thức ăn có hàm lượng protein được tính toán trước [107, 108], cho thấy chế độ dinh dưỡng với hàm lượng protein thấp 20g / ngày có lợi cho sức khoẻ xương trên những bệnh nhân bị gãy cổ xương đùi. Nghiên của chúng tôi trên phụ nữ sau mãn kinh cho thấy tỷ số protein động vật cao có liên quan đến tỷ lệ mất xương ở cổ xương đùi, và ăn nhiều chất đạm động vật có thể gây ảnh hưởng tiêu cực đến xương [109]. Tuy nhiên, cho đến nay, vẫn chưa có một khuyến cáo cụ thể nào về hàm lượng, thành phần cần thiết của thành tố protein với mục đích bảo vệ sức khoẻ xương. Đa số các chuyên gia đều đồng ý là lượng protein trung bình cần thiết cho chuyển hóa xương và chuyển hóa calcium là 1.0 – 1.5g/kg/ngày [110], và nên tăng cường lượng protein thực vật.
Vai trò của một số thành tố khác
Bên cạnh calcium, vitamin D và protein, còn nhiều thành tố dinh dưỡng khác có ảnh hưởng đến sức khỏe xương như phosphorus, kẽm, đồng, manganese, potassium, sodium, magnesium và các vitamin như K, C, A, B. Trong đó, nổi bật là vai trò của phosphorus, potassium, sodium, và vitamin K.
Phosphorus
Cùng với calcium, phosphorus là một trong những chất khoáng cần thiết cho sự tạo thành và phát triển xương, thiếu phosphorus huyết thanh gây rối loạn quá trình khoáng hoá xương và hoạt động tế bào tạo xương. Mặc dù tỉ lệ calcium/ phosphorus trong xương tương đối ổn định, biên độ dao động của tỉ lệ này trong thức ăn rất rộng (0,2-20), và biên độ này không ảnh hưởng đến sự hấp thu và dự trữ của mỗi chất, cũng như không ảnh hưởng đến chức năng khoáng hoá của xương [111]. Ảnh hưởng của phosphorus trên mật độ xương còn nhiều tranh cãi. Nghiên cứu cho thấy thành phần phosphorus trong thức ăn với nhiều mức độ không ảnh hưởng đến hấp thu của calcium cũng như sức khỏe xương ở người bình thường [112]. Tuy nhiên, Calvo et al lại ghi nhận chế độ ăn với hàm lượng phosphorus cao, calcium thấp gây tăng PTH và rối loạn chuyển hoá calcium so với nhóm chứng [113].
Vitamin K
Vitamin K là một cofactor trong quá trình gamma- carboxyl hóa của acid glutamic để tạo thành osteoccalcin, là một protein non-collagen của thành phần chật nền trong xương. Tuy cơ chế ảnh hưởng của vitamin K trong bệnh sinh của loãng xương chưa rõ ràng, nhưng nhiều kết quả nghiên cứu cho thấy có sự liên quan giữa bất thường của vitamin K và loãng xương. Đầu tiên các nghiên cứu ghi nhận có tình trạng giảm nồng độ vitamin K và menoquinone trong huyết thanh ở những bệnh nhân gãy cổ xương đùi [114]; đồng thời cũng tìm thấy nồng độ hydroxyproline niệu và calcium niệu cao ở những bệnh nhân bị loãng xương [115, 116], và tình trạng này cải thiện khi bổ sung vitamin K. Các nghiên cứu quan sát ghi nhận có tình trạng mật độ xương ở vị trí xương đùi và cột sống, ở nhóm đối tượng có hàm lượng vitamin K intake thấp và nồng độ vitamin K huyết thanh thấp, trên người lớn tuổi [117, 118] Nghiên cứu cohort cũng cho thấy nồng độ vitamin K thấp làm tăng nguy cơ gãy cổ xương đùi [119, 120]. Nhiều nghiên thử nghiêm lâm sàng được thực hiện ở Nhật nhằm đánh giá ảnh hưởng của vitamin K lên sức khoẻ xương, cho thấy bổ sung homolog của vitamin K (menatetrenone) liều cao (45-90mg/ngày) có tác dụng tích cực đối với mật độ xương và giảm nguy cơ gãy xương [121, 122]. Mới đây, các thử nghiệm lâm sàng trên người da trắng, cũng ghi nhận vai trò của vitamin K trong điều trị và phòng ngừa loãng xương [123-125]
Nồng độ vitamin K huyết thanh có mối liên quan chặt chẽ với chế độ dinh dưỡng [126, 127], và ảnh hưởng đến sức khoẻ xương. Các thực phẩm chứa nhiều vitamin K bao gồm rau xanh (bó xôi, cải xoắn, cải bẹ xanh, củ cải, ngò tây, rau diếp), gan động vật.
Sodium và potassium
Y văn cho thấy có vai trò của sodium và potassium trong sự phát triển và phòng ngừa loãng xương. Lượng sodium tiêu thụ có liên quan chặt chẽ với sự bài tiết của calcium qua đường niệu, sodium tiêu thụ cao gây rối loạn chuyển hoá calcium, có hại cho chu chuyển xương ở phụ nữ sau mãn kinh [128, 129], làm tăng tỉ lệ mất xương và giảm mật độ xương [130].
Ngược lại với sodium, tiêu thụ nhiều potssium bằng trái cây và rau giúp tăng mật độ xương [131, 132]. Tác dụng bảo vệ của potassium với xương thông qua cơ chế làm giảm acid nội tiết (net endogenous acid production NEAP). Nghiên cứu cũng cho thấy bô sung potassium bicarbonate có tác dụng trung hoà acid nội sinh, giảm mất calcium qua đường niệu, có lợi cho chu chuyển xương [133, 134].
Kết luận
Những dữ liệu ở trên cho thấy ngoại trừ calcium và vitamin D, các thành tố dinh dưỡng khác chưa có những khuyến cáo cụ thể. Và để phòng ngừa loãng xương, NOF (National Osteoporosis Foundation) đã đưa ra khuyến cáo gồm 5 bước như sau:
1. Cung cấp đủ calcium và vitamin D.
2. Chế độ vận động, tập luyện cơ bắp đều đăn mỗi ngày
3. Tránh thuốc lá, rượu bia
4. Tìm bác sĩ tư vấn về sức khoẻ xương
5. Đo mật đô xương và diều trị khi có chỉ định
.:
Tài liệu tham khảo
1. Holick, M.F. and T.C. Chen, Vitamin D deficiency: a worldwide problem with health consequences. Am J Clin Nutr, 2008. 87(4): p. 1080S-6S.
2. Heaney, R.P., Evaluation and interpretation of calcium-kinetic data in man. Clin Orthop Relat Res, 1963. 31: p. 153-83.
3. Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, F.a.N.B., Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academy Press, 2010.
4. 1994;12:1-31., N.I.o.H.O.c.i.N.C.S.
5. Weaver, C.M., W.R. Proulx, and R. Heaney, Choices for achieving adequate dietary calcium with a vegetarian diet. Am J Clin Nutr, 1999. 70(3 Suppl): p. 543S-548S.
6. Heaney, R.P., Bone mass, nutrition, and other lifestyle factors. Nutr Rev, 1996. 54(4 Pt 2): p. S3-10.
7. Kerstetter, J.E., et al., The impact of dietary protein on calcium absorption and kinetic measures of bone turnover in women. J Clin Endocrinol Metab, 2005. 90(1): p. 26-31.
8. Barrett-Connor, E., J.C. Chang, and S.L. Edelstein, Coffee-associated osteoporosis offset by daily milk consumption. The Rancho Bernardo Study. Jama, 1994. 271(4): p. 280-3.
9. Massey, L.K. and S.J. Whiting, Caffeine, urinary calcium, calcium metabolism and bone. J Nutr, 1993. 123(9): p. 1611-4.
10. U.S. Department of Agriculture. Results from the United States Department of Agriculture's 1994-96 Continuing Survey of Food Intakes by Individuals/Diet and Health Knowledge Survey, -.
11. Cumming, R.G., Calcium intake and bone mass: a quantitative review of the evidence. Calcif Tissue Int, 1990. 47(4): p. 194-201.
12. Welten, D.C., et al., A meta-analysis of the effect of calcium intake on bone mass in young and middle aged females and males. J Nutr, 1995. 125(11): p. 2802-13.
13. Ferrari, S.L., et al., Childhood fractures are associated with decreased bone mass gain during puberty: an early marker of persistent bone fragility? J Bone Miner Res, 2006. 21(4): p. 501-7.
14. Goulding, A., et al., Children who avoid drinking cow's milk are at increased risk for prepubertal bone fractures. J Am Diet Assoc, 2004. 104(2): p. 250-3.
15. Ma, D. and G. Jones, The association between bone mineral density, metacarpal morphometry, and upper limb fractures in children: a population-based case-control study. J Clin Endocrinol Metab, 2003. 88(4): p. 1486-91.
16. Bonjour, J.P., et al., Calcium-enriched foods and bone mass growth in prepubertal girls: a randomized, double-blind, placebo-controlled trial. J Clin Invest, 1997. 99(6): p. 1287-94.
17. Chevalley, T., et al., Skeletal site selectivity in the effects of calcium supplementation on areal bone mineral density gain: a randomized, double-blind, placebo-controlled trial in prepubertal boys. J Clin Endocrinol Metab, 2005. 90(6): p. 3342-9.
18. Chevalley, T., et al., High-protein intake enhances the positive impact of physical activity on BMC in prepubertal boys. J Bone Miner Res, 2008. 23(1): p. 131-42.
19. Prentice, A., Is nutrition important in osteoporosis? Proc Nutr Soc, 1997. 56(1B): p. 357-67.
20. Riis, B., K. Thomsen, and C. Christiansen, Does calcium supplementation prevent postmenopausal bone loss? A double-blind, controlled clinical study. N Engl J Med, 1987. 316(4): p. 173-7.
21. Elders, P.J., et al., Long-term effect of calcium supplementation on bone loss in perimenopausal women. J Bone Miner Res, 1994. 9(7): p. 963-70.
22. Dawson-Hughes, B., et al., A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women. N Engl J Med, 1990. 323(13): p. 878-83.
23. Riggs, B.L., et al., Long-term effects of calcium supplementation on serum parathyroid hormone level, bone turnover, and bone loss in elderly women. J Bone Miner Res, 1998. 13(2): p. 168-74.
24. Reid, I.R., et al., Effect of calcium supplementation on bone loss in postmenopausal women. N Engl J Med, 1993. 328(7): p. 460-4.
25. Prince, R., et al., The effects of calcium supplementation (milk powder or tablets) and exercise on bone density in postmenopausal women. J Bone Miner Res, 1995. 10(7): p. 1068-75.
26. Peacock, M., et al., Effect of calcium or 25OH vitamin D3 dietary supplementation on bone loss at the hip in men and women over the age of 60. J Clin Endocrinol Metab, 2000. 85(9): p. 3011-9.
27. Shea, B., et al., Meta-analyses of therapies for postmenopausal osteoporosis. VII. Meta-analysis of calcium supplementation for the prevention of postmenopausal osteoporosis. Endocr Rev, 2002. 23(4): p. 552-9.
28. Cumming, R.G. and M.C. Nevitt, Calcium for prevention of osteoporotic fractures in postmenopausal women. J Bone Miner Res, 1997. 12(9): p. 1321-9.
29. Lau, E., et al., Physical activity and calcium intake in fracture of the proximal femur in Hong Kong. Bmj, 1988. 297(6661): p. 1441-3.
30. Holbrook, T.L., E. Barrett-Connor, and D.L. Wingard, Dietary calcium and risk of hip fracture: 14-year prospective population study. Lancet, 1988. 2(8619): p. 1046-9.
31. Kreiger, N., A. Gross, and G. Hunter, Dietary factors and fracture in postmenopausal women: a case-control study. Int J Epidemiol, 1992. 21(5): p. 953-8.
32. Cummings, S.R., et al., Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med, 1995. 332(12): p. 767-73.
33. Wickham, C.A., et al., Dietary calcium, physical activity, and risk of hip fracture: a prospective study. Bmj, 1989. 299(6704): p. 889-92.
34. Cooper, C., D.J. Barker, and C. Wickham, Physical activity, muscle strength, and calcium intake in fracture of the proximal femur in Britain. BMJ, 1988. 297(6661): p. 1443-6.
35. Cumming, R.G. and R.J. Klineberg, Case-control study of risk factors for hip fractures in the elderly. Am J Epidemiol, 1994. 139(5): p. 493-503.
36. Chen, R.D., et al., Isolation of an osmotic stress- and abscisic acid-induced gene encoding an acidic endochitinase from Lycopersicon chilense. Mol Gen Genet, 1994. 245(2): p. 195-202.
37. Recker, R.R., et al., Correcting calcium nutritional deficiency prevents spine fractures in elderly women. J Bone Miner Res, 1996. 11(12): p. 1961-6.
38. Reid, I.R., et al., Long-term effects of calcium supplementation on bone loss and fractures in postmenopausal women: a randomized controlled trial. Am J Med, 1995. 98(4): p. 331-5.
39. Johnston, C.C., Jr., et al., Calcium supplementation and increases in bone mineral density in children. N Engl J Med, 1992. 327(2): p. 82-7.
40. Bonjour, J.P., et al., Gain in bone mineral mass in prepubertal girls 3.5 years after discontinuation of calcium supplementation: a follow-up study. Lancet, 2001. 358(9289): p. 1208-12.
41. Cadogan, J., et al., Milk intake and bone mineral acquisition in adolescent girls: randomised, controlled intervention trial. Bmj, 1997. 315(7118): p. 1255-60.
42. Prentice, A., et al., Calcium supplementation increases stature and bone mineral mass of 16- to 18-year-old boys. J Clin Endocrinol Metab, 2005. 90(6): p. 3153-61.
43. Dibba, B., et al., Effect of calcium supplementation on bone mineral accretion in gambian children accustomed to a low-calcium diet. Am J Clin Nutr, 2000. 71(2): p. 544-9.
44. Bounds, W., et al., The relationship of dietary and lifestyle factors to bone mineral indexes in children. J Am Diet Assoc, 2005. 105(5): p. 735-41.
45. Chan, G.M., K. Hoffman, and M. McMurry, Effects of dairy products on bone and body composition in pubertal girls. J Pediatr, 1995. 126(4): p. 551-6.
46. Black, R.E., et al., Children who avoid drinking cow milk have low dietary calcium intakes and poor bone health. Am J Clin Nutr, 2002. 76(3): p. 675-80.
47. Henderson, R.C. and P.R. Hayes, Bone mineralization in children and adolescents with a milk allergy. Bone Miner, 1994. 27(1): p. 1-12.
48. Infante, D. and R. Tormo, Risk of inadequate bone mineralization in diseases involving long-term suppression of dairy products. J Pediatr Gastroenterol Nutr, 2000. 30(3): p. 310-3.
49. Jensen, V.B., et al., Bone mineral status in children with cow milk allergy. Pediatr Allergy Immunol, 2004. 15(6): p. 562-5.
50. Rockell, J.E., et al., Two-year changes in bone and body composition in young children with a history of prolonged milk avoidance. Osteoporos Int, 2005. 16(9): p. 1016-23.
51. Teegarden, D., et al., Previous milk consumption is associated with greater bone density in young women. Am J Clin Nutr, 1999. 69(5): p. 1014-7.
52. Wiley, A.S., Does milk make children grow? Relationships between milk consumption and height in NHANES 1999-2002. Am J Hum Biol, 2005. 17(4): p. 425-41.
53. Moschonis, G., et al., The effects of a 30-month dietary intervention on bone mineral density: the Postmenopausal Health Study. Br J Nutr, 2010. 104(1): p. 100-7.
54. Manios, Y., et al., Changes in diet quality score, macro- and micronutrients intake following a nutrition education intervention in postmenopausal women. J Hum Nutr Diet, 2007. 20(2): p. 126-31.
55. Bonjour, J.P., et al., Inhibition of markers of bone resorption by consumption of vitamin D and calcium-fortified soft plain cheese by institutionalised elderly women. Br J Nutr, 2009. 102(7): p. 962-6.
56. Palacios, S., et al., Changes in bone turnover markers after calcium-enriched milk supplementation in healthy postmenopausal women: a randomized, double-blind, prospective clinical trial. Menopause, 2005. 12(1): p. 63-8.
57. Cheng, S., et al., Effects of calcium, dairy product, and vitamin D supplementation on bone mass accrual and body composition in 10-12-y-old girls: a 2-y randomized trial. Am J Clin Nutr, 2005. 82(5): p. 1115-26; quiz 1147-8.
58. Ho-Pham, L.T., et al., Veganism, bone mineral density, and body composition: a study in Buddhist nuns. Osteoporos Int, 2009. 20(12): p. 2087-93.
59. Straub, D.A., Calcium supplementation in clinical practice: a review of forms, doses, and indications. Nutr Clin Pract, 2007. 22(3): p. 286-96.
60. Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, DC: National Academy Press;, 1997.
61. Lips, P., Vitamin D physiology. Prog Biophys Mol Biol, 2006. 92(1): p. 4-8.
62. Holick, M.F., Vitamin D: a D-Lightful health perspective. Nutr Rev, 2008. 66(10 Suppl 2): p. S182-94.
63. Holick, M.F., The parathyroid hormone D-lema. J Clin Endocrinol Metab, 2003. 88(8): p. 3499-500.
64. Holick, M.F., Vitamin D deficiency. N Engl J Med, 2007. 357(3): p. 266-81.
65. Bouillon, R., W.H. Okamura, and A.W. Norman, Structure-function relationships in the vitamin D endocrine system. Endocr Rev, 1995. 16(2): p. 200-57.
66. Holick, M.F., The influence of vitamin D on bone health across the life cycle. J Nutr, 2005. 135(11): p. 2726S-7S.
67. Heaney, R.P., et al., Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr, 2003. 22(2): p. 142-6.
68. Holick, M.F., High prevalence of vitamin D inadequacy and implications for health. Mayo Clin Proc, 2006. 81(3): p. 353-73.
69. Thomas, M.K., et al., Hypovitaminosis D in medical inpatients. N Engl J Med, 1998. 338(12): p. 777-83.
70. Bischoff-Ferrari, H.A., et al., Dietary Calcium and Serum 25-hydroxyvitamin D Status in Relation to Bone Mineral Density Among U.S. Adults. J Bone Miner Res, 2008.
71. Dusso, A.S., A.J. Brown, and E. Slatopolsky, Vitamin D. Am J Physiol Renal Physiol, 2005. 289(1): p. F8-28.
72. Chapuy, M.C., et al., Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int, 1997. 7(5): p. 439-43.
73. Boonen, S., et al., Calcium and vitamin D in the prevention and treatment of osteoporosis - a clinical update. J Intern Med, 2006. 259(6): p. 539-52.
74. Seamans, K.M., et al., Cholecalciferol supplementation throughout winter does not affect markers of bone turnover in healthy young and elderly adults. J Nutr, 2010. 140(3): p. 454-60.
75. Hitz, M.F., J.E. Jensen, and P.C. Eskildsen, Bone mineral density and bone markers in patients with a recent low-energy fracture: effect of 1 y of treatment with calcium and vitamin D. Am J Clin Nutr, 2007. 86(1): p. 251-9.
76. Meier, C., et al., Supplementation with oral vitamin D3 and calcium during winter prevents seasonal bone loss: a randomized controlled open-label prospective trial. J Bone Miner Res, 2004. 19(8): p. 1221-30.
77. Ooms, M.E., et al., Prevention of bone loss by vitamin D supplementation in elderly women: a randomized double-blind trial. J Clin Endocrinol Metab, 1995. 80(4): p. 1052-8.
78. Chapuy, M.C., et al., Vitamin D3 and calcium to prevent hip fractures in the elderly women. N Engl J Med, 1992. 327(23): p. 1637-42.
79. Dawson-Hughes, B., et al., Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med, 1997. 337(10): p. 670-6.
80. Bischoff-Ferrari, H.A., et al., Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA, 2005. 293(18): p. 2257-64.
81. Jackson, R.D., et al., Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med, 2006. 354(7): p. 669-83.
82. Grant, A.M., et al., Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet, 2005. 365(9471): p. 1621-8.
83. Reid, I.R., M.J. Bolland, and A. Grey, Effect of calcium supplementation on hip fractures. Osteoporos Int, 2008. 19(8): p. 1119-23.
84. Tang, B.M., et al., Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet, 2007. 370(9588): p. 657-66.
85. Avenell, A., et al., Vitamin D and vitamin D analogues for preventing fractures associated with involutional and post-menopausal osteoporosis. Cochrane Database Syst Rev, 2009(2): p. CD000227.
86. Bouillon, R., A.W. Norman, and P. Lips, Vitamin D deficiency. N Engl J Med, 2007. 357(19): p. 1980-1; author reply 1981-2.
87. Lips, P., et al., The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med, 2006. 260(3): p. 245-54.
88. Ho-Pham, L.T., et al., Vitamin D status and parathyroid hormone in a urban population in Vietnam. Osteoporos Int, 2011. 22(1): p. 241-8.
89. Ross, A.C., et al., The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab, 2011. 96(1): p. 53-8.
90. Dawson-Hughes, B. and S.S. Harris, Calcium intake influences the association of protein intake with rates of bone loss in elderly men and women. Am J Clin Nutr, 2002. 75(4): p. 773-9.
91. Abelow, B.J., T.R. Holford, and K.L. Insogna, Cross-cultural association between dietary animal protein and hip fracture: a hypothesis. Calcif Tissue Int, 1992. 50(1): p. 14-8.
92. Frassetto, L.A., et al., Worldwide incidence of hip fracture in elderly women: relation to consumption of animal and vegetable foods. J Gerontol A Biol Sci Med Sci, 2000. 55(10): p. M585-92.
93. Barzel, U.S. and L.K. Massey, Excess dietary protein can adversely affect bone. J Nutr, 1998. 128(6): p. 1051-3.
94. Alexy, U., et al., Long-term protein intake and dietary potential renal acid load are associated with bone modeling and remodeling at the proximal radius in healthy children. Am J Clin Nutr, 2005. 82(5): p. 1107-14.
95. Hannan, M.T., et al., Risk factors for longitudinal bone loss in elderly men and women: the Framingham Osteoporosis Study. J Bone Miner Res, 2000. 15(4): p. 710-20.
96. Munger, R.G., J.R. Cerhan, and B.C. Chiu, Prospective study of dietary protein intake and risk of hip fracture in postmenopausal women. Am J Clin Nutr, 1999. 69(1): p. 147-52.
97. Wengreen, H.J., et al., Dietary protein intake and risk of osteoporotic hip fracture in elderly residents of Utah. J Bone Miner Res, 2004. 19(4): p. 537-45.
98. Sellmeyer, D.E., et al., A high ratio of dietary animal to vegetable protein increases the rate of bone loss and the risk of fracture in postmenopausal women. Study of Osteoporotic Fractures Research Group. Am J Clin Nutr, 2001. 73(1): p. 118-22.
99. Cooper, C., et al., Dietary protein intake and bone mass in women. Calcif Tissue Int, 1996. 58(5): p. 320-5.
100. Hirota, T., et al., Effect of diet and lifestyle on bone mass in Asian young women. Am J Clin Nutr, 1992. 55(6): p. 1168-73.
101. Chiu, J.F., et al., Long-term vegetarian diet and bone mineral density in postmenopausal Taiwanese women. Calcif Tissue Int, 1997. 60(3): p. 245-9.
102. Devine, A., et al., Protein consumption is an important predictor of lower limb bone mass in elderly women. Am J Clin Nutr, 2005. 81(6): p. 1423-8.
103. Hannan, M.T., et al., Effect of dietary protein on bone loss in elderly men and women: the Framingham Osteoporosis Study. J Bone Miner Res, 2000. 15(12): p. 2504-12.
104. Yee, W.L. and J.R. Anderson, Free flight of Lambornella clarki-infected, blood-fed, and gravid Aedes sierrensis (Diptera: Culicidae). J Med Entomol, 1995. 32(4): p. 407-12.
105. Metz, J.A., J.J. Anderson, and P.N. Gallagher, Jr., Intakes of calcium, phosphorus, and protein, and physical-activity level are related to radial bone mass in young adult women. Am J Clin Nutr, 1993. 58(4): p. 537-42.
106. Bone health nutrition issues in aging, 2010. p. 1086-1105.
107. Delmi, M., et al., Dietary supplementation in elderly patients with fractured neck of the femur. Lancet, 1990. 335(8696): p. 1013-6.
108. Tkatch, L., et al., Benefits of oral protein supplementation in elderly patients with fracture of the proximal femur. J Am Coll Nutr, 1992. 11(5): p. 519-25.
109. Hồ Phạm Thục Lan, Vũ Quốc Bảo, Lại Quốc Thái, Phạm Ngọc Hoa,Nguyễn Đình Nguyên, Nguyễn Văn Tuấn. Thay đổi mật độ xương ở phụ nữ sau mãn kinh:Yếu tố nguy cơ. Thời sự Y học TP Hồ Chí Minh. Tháng 08. , 2010.
110. Kerstetter, J.E., K.O. O'Brien, and K.L. Insogna, Dietary protein, calcium metabolism, and skeletal homeostasis revisited. Am J Clin Nutr, 2003. 78(3 Suppl): p. 584S-592S.
111. Heaney, R.P. and R.R. Recker, Effects of nitrogen, phosphorus, and caffeine on calcium balance in women. J Lab Clin Med, 1982. 99(1): p. 46-55.
112. Spencer, H., et al., Effect of phosphorus on the absorption of calcium and on the calcium balance in man. J Nutr, 1978. 108(3): p. 447-57.
113. Calvo, M.S., R. Kumar, and H. Heath, Persistently elevated parathyroid hormone secretion and action in young women after four weeks of ingesting high phosphorus, low calcium diets. J Clin Endocrinol Metab, 1990. 70(5): p. 1334-40.
114. Hodges, S.J., et al., Depressed levels of circulating menaquinones in patients with osteoporotic fractures of the spine and femoral neck. Bone, 1991. 12(6): p. 387-9.
115. Knapen, M.H., K. Hamulyak, and C. Vermeer, The effect of vitamin K supplementation on circulating osteocalcin (bone Gla protein) and urinary calcium excretion. Ann Intern Med, 1989. 111(12): p. 1001-5.
116. Vermeer, C. and K. Hamulyak, Pathophysiology of vitamin K-deficiency and oral anticoagulants. Thromb Haemost, 1991. 66(1): p. 153-9.
117. Booth, S.L., et al., Associations between vitamin K biochemical measures and bone mineral density in men and women. J Clin Endocrinol Metab, 2004. 89(10): p. 4904-9.
118. Booth, S.L., et al., Vitamin K intake and bone mineral density in women and men. Am J Clin Nutr, 2003. 77(2): p. 512-6.
119. Feskanich, D., et al., Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr, 1999. 69(1): p. 74-9.
120. Booth, S.L., et al., Dietary vitamin K intakes are associated with hip fracture but not with bone mineral density in elderly men and women. Am J Clin Nutr, 2000. 71(5): p. 1201-8.
121. Shiraki, M., et al., Vitamin K2 (menatetrenone) effectively prevents fractures and sustains lumbar bone mineral density in osteoporosis. J Bone Miner Res, 2000. 15(3): p. 515-21.
122. Iwamoto, J., T. Takeda, and S. Ichimura, Effect of menatetrenone on bone mineral density and incidence of vertebral fractures in postmenopausal women with osteoporosis: a comparison with the effect of etidronate. J Orthop Sci, 2001. 6(6): p. 487-92.
123. Booth, S.L., et al., Effect of vitamin K supplementation on bone loss in elderly men and women. J Clin Endocrinol Metab, 2008. 93(4): p. 1217-23.
124. Bolton-Smith, C., et al., Two-year randomized controlled trial of vitamin K1 (phylloquinone) and vitamin D3 plus calcium on the bone health of older women. J Bone Miner Res, 2007. 22(4): p. 509-19.
125. Braam, L.A., et al., Vitamin K1 supplementation retards bone loss in postmenopausal women between 50 and 60 years of age. Calcif Tissue Int, 2003. 73(1): p. 21-6.
126. Geinoz, G., et al., Relationship between bone mineral density and dietary intakes in the elderly. Osteoporos Int, 1993. 3(5): p. 242-8.
127. Rico, H., et al., Crush fracture syndrome in senile osteoporosis: a nutritional consequence? J Bone Miner Res, 1992. 7(3): p. 317-9.
128. Dawson-Hughes, B., et al., Sodium excretion influences calcium homeostasis in elderly men and women. J Nutr, 1996. 126(9): p. 2107-12.
129. Evans, C.E., et al., The effect of dietary sodium on calcium metabolism in premenopausal and postmenopausal women. Eur J Clin Nutr, 1997. 51(6): p. 394-9.
130. Devine, A., et al., A longitudinal study of the effect of sodium and calcium intakes on regional bone density in postmenopausal women. Am J Clin Nutr, 1995. 62(4): p. 740-5.
131. New, S.A., et al., Dietary influences on bone mass and bone metabolism: further evidence of a positive link between fruit and vegetable consumption and bone health? Am J Clin Nutr, 2000. 71(1): p. 142-51.
132. Tucker, K.L., et al., Potassium, magnesium, and fruit and vegetable intakes are associated with greater bone mineral density in elderly men and women. Am J Clin Nutr, 1999. 69(4): p. 727-36.
133. Wood, R.J., Potassium bicarbonate supplementation and calcium metabolism in postmenopausal women: are we barking up the wrong tree? Nutr Rev, 1994. 52(8 Pt 1): p. 278-80.
134. Sebastian, A., et al., Improved mineral balance and skeletal metabolism in postmenopausal women treated with potassium bicarbonate. N Engl J Med, 1994. 330(25): p. 1776-81.


