Mô hình tiên lượng loãng xương cho người Việt Nam
20/01/2021
Hiện nay ở các quốc gia đang phát triển, bao gồm cả Việt Nam, đang đối diện với tình trạng thiếu hụt máy DXA được xem là tiêu chuẩn vàng cho chẩn đoán loãng xương, đặc biệt ở các vùng sâu vùng xa thành thị. Điều này gây khó khăn trong quá trình điều trị và phòng ngừa bệnh ở mức độ cá thể. Do đó, chúng tôi đã nghiên cứu phát triển mô hình tiên lượng loãng xương dựa trên tuổi và cân nặng cho nam và nữ ở mức độ cá thể. Mô hình này sẽ được dùng vào việc tuyển chọn đối tượng để điều trị loãng xương và loại bỏ những trường hợp không cần phải đo mật độ xương bằng máy DXA; có thể góp phần hữu ích cho công cuộc phòng ngừa loãng xương đặc biệt ở vùng nông thôn .
Tóm tắt
Hiện nay ở các quốc gia đang phát triển, bao gồm cả Việt Nam, đang đối diện với tình trạng thiếu hụt máy DXA được xem là tiêu chuẩn vàng cho chẩn đoán loãng xương, đặc biệt ở các vùng sâu vùng xa thành thị. Điều này gây khó khăn trong quá trình điều trị và phòng ngừa bệnh ở mức độ cá thể. Do đó, chúng tôi đã nghiên cứu phát triển mô hình tiên lượng loãng xương dựa trên tuổi và cân nặng cho nam và nữ ở mức độ cá thể. Mô hình này sẽ được dùng vào việc tuyển chọn đối tượng để điều trị loãng xương và loại bỏ những trường hợp không cần phải đo mật độ xương bằng máy DXA; có thể góp phần hữu ích cho công cuộc phòng ngừa loãng xương đặc biệt ở vùng nông thôn .
Loãng xương là một bệnh nội tiết với hai đặc điểm là sức mạnh của xương bị suy yếu và cấu trúc của xương bị suy giảm (1). Hệ quả của loãng xương là gãy xương. Các xương quan trọng thường bị gãy gồm có xương cột sống, cổ xương đùi và xương cẳng tay. Gãy xương là một vấn đề y tế có tầm vĩ mô, do tần suất cao và hệ quả nghiêm trọng của bệnh. Theo một nghiên cứu dịch tễ học trong người da trắng, cứ 2 phụ nữ sống đến tuổi 85 thì có 1 phụ nữ bị gãy xương, và cứ 3 đàn ông sống cùng độ tuổi thì có 1 người sẽ bị gãy xương (2). Nguy cơ bị gãy xương đùi trong phụ nữ tương đương với nguy cơ bị ung thư vú (3). Gãy xương là một trong những nguyên nhân làm giảm tuổi thọ. Khoảng phân nửa các trường hợp nữ bị gãy xương sẽ tử vong trong 7 năm,và con số này ở nam giới là 5 năm (2). Đối với những bệnh nhân sống sót sau gãy xương, sẽ có nguy cơ cao bị gãy xương tái phát cũng như mắc các bệnh nội khoa khác và chất lượng cuộc sống giảm đáng kể. Không chỉ chi phí cao cho điều trị, các trường hợp gãy xương bị giảm đến mất khả năng vận động, cần sự chăm sóc và hỗ trợ của người khác, làm ảnh hưởng đến nhân lực lao động và ảnh hưởng đến kinh tế quốc gia. Theo phân tích của giới kinh tế, chi phí xã hội bị mất đi vì gãy xương lên đến con số 14 tỉ Mĩ kim ở Mĩ (4). Chính vì các hậu quả sức khỏe và kinh tế này mà loãng xương hiện đang được đánh giá là một trong những mối quan tâm hàng đầu của y tế công cộng thế giới.
Đo mật độ xương bằng phương pháp DEXA
Ở nước ta, loãng xương cũng được các giới chức y tế rất quan tâm vì tuổi thọ người Việt đang nhanh chóng gia tăng cùng với đà phát triển đô thị. Trong một nghiên cứu gần đây (5), chúng tôi đã cho thấy khoảng 30% phụ nữ và 10% đàn ông trên 50 tuổi có bệnh loãng xương. Tỷ lệ hiện mắc này phù hợp với sự quan sát trong quần thể dân số người da trắng (6). Trong bối cảnh lão hoá dân số và đà phát triển đô thị tăng nhanh, loãng xương và hậu quả gãy xương sẽ trở thành gánh nặng y tế thật sự cho cộng đồng Việt Nam.
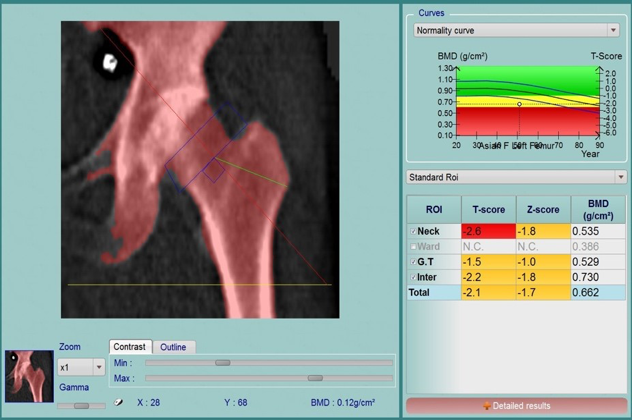
Hiện nay tiêu chuẩn vàng để chẩn đoán bệnh loãng xương là dựa vào đo mật độ xương (BMD) bằng phương pháp hấp thu tia X năng lượng kép (DXA). Theo khuyến cáo của Tổ chức Y tế Thế giới, mật độ xương (BMD) của mỗi cá nhân dưới -2.5 độ lệch chuẩn so với mức trung bình của người trẻ (từ 20 đến 30 tuổi) được cho là có bệnh loãng xương (7). Việc dựa vào công cụ DXA để chẩn đoán bệnh loãng xương gây nên những khó khăn nhất định cho quần thể dân số gặp hạn chế trong việc tiếp cận với DXA. Ví dụ, ở Việt Nam phần lớn dân cư sống ở khu vực nông thôn, nơi DXA không được sử dụng phổ biến. Trong khi đó, toàn quốc có khoảng 90 máy đo mật độ xương DXA, nhưng phần lớn 90% số máy tập trung ở các thành phố lớn. Điều này đặt ra thử thách cho việc phát triển công cụ giúp phát hiện những cá nhân mắc bệnh không triệu chứng trong việc kiểm soát bệnh loãng xương ở mức độ cá thể.
Nhiều mô hình dự đoán bệnh đã được phát triển dùng để ước tính nguy cơ mắc loãng xương, và các công cụ này từ đơn giản, chỉ dựa vào trọng lượng cơ thể (8) hoặc tuổi và cân nặng như OSTA (9), KKOS (10), đến phức tạp như (ORAI (11), SCORE (12), OSIRIS (13), ABONE (14) và MOST (15) bao gồm liệu pháp estrogen, tiền sử gãy xương, viêm khớp dạng thấp và tình trạng tiền mãn kinh. Nhiều nghiên cứu đã được thực hiện nhằm so sánh hiệu quả của các công cụ này (16-23), và kết quả cho thấy các công cụ đơn giản hoạt động tương đương hoặc tốt hơn các công cụ phức tạp (25-28). Trong đó, OSTA được đánh giá là công cụ thân thiện nhất và hiệu quả nhất trong thực hành lâm sàng (24, 25).
Tuy nhiên, hiệu suất dự đoán của các công cụ có thể phụ thuộc vào đặc điểm dân số. Kết từ các nghiên cứu trước đây ở các nhóm dân số Hàn Quốc (26), Trung Quốc (21), Thái Lan (27), Ấn Độ (23), Phillipin (28) và Trung Quốc (29) cho thấy chỉ số OSTA có độ nhạy tốt (70-80%) nhưng độ đặc hiệu thấp (30-40%). Hơn nữa, nhược điểm của chỉ số OSTA là việc phân loại xác suất ước tính vào nhóm “âm tính” và “dương tính”, điều này có thể dẫn đến việc mất thông tin. Do đó, hai cá thể có sự khác biệt nhỏ trong xác suất mắc bệnh loãng xương nhưng có thể được phân vào hai nhóm riêng biệt.
Trước tình hình thiếu hụt DXA dùng để chẩn đoán bệnh loãng xương ở các vùng xa thành phố, đồng thời các mô hình đang lưu hành trên thế giới chưa được kiểm định cho cộng đồng Việt Nam, gây khó khăn trong quá trình điều trị và phòng ngừa bệnh ở mức độ cá thể. Do đó, chúng tôi đã thực hiện nghiên cứu nhằm phát triển và hợp thức hóa một mô hình dự đoán bệnh dành cho đánh giá loãng xương ở từng cá thể dựa trên tuổi và cân nặng cho nam và nữ.
Nghiên cứu này là một phần của Nghiên cứu Loãng xương Việt Nam (Vietnam Osteoporosis Study - VOS) (30), được thiết kế như một nghiên cứu theo thời gian dựa trên dân số, bắt đầu vào năm 2015 tại thành phố Hồ Chí Minh. Trong nghiên cứu này, chúng tôi bao gồm 1477 nữ và 669 nam trên 50 tuổi. Phương pháp thực hiện và quy trình nghiên cứu đã được kiểm chứng và thông qua bởi Hội đồng nghiên cứu và đạo đức Bệnh viện Nhân dân 115. Các đặc điểm dân số học bao gồm yếu tố lối sống và thông tin lâm sàng được xác định thông qua bảng câu hỏi; mật độ xương tại 2 vị trí cổ xương đùi, và cột sống thắt lưng (L2-L4) được đo bằng máy hấp thu tia X năng lượng kép (DXA; Hologic QDR Apex 4500). Chỉ số T-score được tính cho từng cá nhân dựa trên mật độ xương đỉnh cho người Việt Nam theo giới đã được công bố trước đây (5). T-score được xác định ở vị trí cổ xương đùi và cột sống thắt lưng. Ở mỗi vị trí, mỗi cá nhân được phân thành 3 nhóm dựa vào T-score theo khuyến cáo của Tổ chức Y tế Thế giới (7): BMD bình thường (T-score từ -1.00 trở lên); thiếu xương (T-score từ -1.01 đến 2.49); và loãng xương (T-score từ dưới -2.50).
Chúng tôi sử dụng kỹ thuật phân tích hồi quy logistic để lập mô hình xác suất mắc bệnh loãng xương dựa trên mối liên hệ hàm số giữa tuổi và cân nặng. Theo mô hình này, xác suất tiên lượng mắc bệnh loãng xương (P) được tính bằng , trong đó a,b và c là những tham số được ước tính từ nghiên cứu quan sát. Mô hình được sử dụng riêng cho nam và nữ. Để đánh giá khả năng phân biệt và hiệu chuẩn của mô hình, chúng tôi dùng phương pháp bootstrap với lặp lại 100 lần các mẫu. Trong mỗi mẫu, chúng tôi tính diện tích dưới đường cong (AUC), và chỉ số Brier; với AUC phản ánh sự phù hợp giữa các ca quan sát và xác suất tiên lượng của bệnh, giá trị AUC trên 0.8 được cho là có ý nghĩa lâm sàng. Chỉ số Brier là sai số dự đoán trung bình bình phương, giá trị Brier càng thấp hiệu suất của mô hình càng cao. Chúng tôi cũng ước tính chỉ số OSTA dựa vào cân nặng (đơn vị kg) và tuổi theo công thức: OSTA = 0.2 ; và phân nhóm “nguy cơ cao” nếu OSTA -1 và “nguy cơ thấp”nếu OSTA -1 (31). Sau đó, tần suất các nhóm OSTA được so sánh với tần suất thực của loãng xương để tính độ nhạy và độ đặc hiệu, AUC và chỉ số Brier cũng được tính.
Kết quả phân tích cho thấy ở nữ, tăng mỗi năm tuổi làm tăng tỉ số odds loãng xương 13% (95% CI, 11 đến 15), nhưng tăng mỗi kg cân nặng lại làm giảm tỉ số odds loãng xương 11% (95% CI, 9 đến 13). Kết quả tương tự cũng được ghi nhận ở nam. Và chúng tôi đã thiết lập được công thức tính nguy cơ bệnh loãng xương (P) ở cổ xương đùi như sau:
Chúng tôi tìm thấy ở nữ, ngưỡng nguy cơ là 0.195, mô hình có độ nhạy và độ đặc hiệu lần lượt là 0.785 và 0.720, với độ chính xác thể hiện quan diện tích dưới đường cong AUC = 0.825 và chỉ số Brier = 0.112 (Hình 1). Ở nam, ngưỡng nguy cơ là 0.09, độ nhạy và độ đặc hiệu lần lượt là 0.872 và 0.696; với AUC = 0.858 và chỉ số Brier = 0.040 (Hình 1).


Hình 1. Độ nhạy, độ đặc hiệu, diện tích dưới đường cong ở nữ (trái) và nam (phải)
Trong khi đó, chúng tôi ghi nhận chỉ số OSTA có độ chính xác khiêm tốn; ở nữ, OSTA ở ngưỡng -1 có độ nhạy và độ đặc hiệu lần lượt là 87% và 58%, AUC = 0.601, và chỉ số Brier = 0.191; ở nam: độ nhạy và độ đặc hiệu của OSTA lần lượt là 83% và 74%, AUC = 0.644, và chỉ số Brier = 0.126. Do độ chính xác thấp, OSTA không thể dùng được cho dân số Việt Nam, mặc dù đây là mô hình được sử dụng phổ biến nhất ở các nước châu Á. Trong mô hình đại diện cho dân số Việt Nam của chúng tôi, diện tích dưới đường cong ROC luôn cao hơn 0.80, và đạt hiệu chuẩn chính xác, điều này cho thấy mô hình có thể hữu ích trong thực hành lâm sàng ở người Việt Nam.
Mô hình tiên lượng này sẽ được sử dụng như thế nào? DXA là tiêu chuẩn vàng hiện nay dùng để chẩn đoán bệnh loãng xương. Vì vậy, mô hình này có thể được dùng như bước đầu tiên sàng lọc các cá nhân có nguy cơ cao bị loãng xương. Trong điều kiện thiếu DXA, mô hình này có thể dùng để ước tính nguy cơ mắc loãng xương cho từng cá thể trên 50 tuổi, và nếu các cá thể có nguy cơ cao (ví dụ trên 20% ở nữ và trên 10% ở nam) những cá nhân này có thể được yêu cầu thực hiện phương pháp đo DXA để xác định chẩn đoán. Việc ưu tiên các cá nhân có nguy cơ cao được đo mật độ xương nhờ vào công cụ này có thể giúp giảm nhẹ gánh nặng của DXA và biến chứng gãy xương.
Các kết quả hiện tại nên được xem xét cả ưu điểm và khuyết điểm. Nghiên cứu được dựa trên nghiên cứu đoàn hệ quy mô lớn và chất lượng cao, lấy mẫu từ dân số chung. Mật độ xương được đo bằng máy hiện đại với độ chính xác cao. Tuy vậy, mô hình này vẫn chưa được ứng dụng trong một quần thể độc lập khác, cho nên giá trị tiên lượng ngoại vi (external validity) vẫn chưa thể xác định. Do đó, một trong những nghiên cứu tương lai là thẩm định tính chính xác và hợp lí của mô hình này.
Kết luận, tại các nước đang phát triển, bao gồm Việt Nam, còn tồn tại tình trạng thiếu hụt máy DXA cho chẩn đoán loãng xương, dẫn đến nhiều khó khăn trong việc điều trị và phòng ngừa bệnh ở mức độ cá thể. Trong nghiên cứu dựa vào dân số này, chúng tôi đã phát triển mô hình dự đoán sử dụng cho việc ước tính nguy cơ mắc bệnh loãng xương cho từng cá thể nam và nữ dựa vào tuổi và cân nặng. Mô hình này sẽ được dùng vào việc tuyển chọn đối tượng để điều trị loãng xương và loại bỏ những trường hợp không cần phải đo mật độ xương bằng máy DXA; có thể góp phần hữu ích cho công cuộc phòng ngừa loãng xương đặc biệt ở vùng sâu vùng xa.
#Trung tâm nghiên cứu Y sinh, Trường Đại học Y khoa Phạm Ngọc Thạch
*Viện nghiên cứu y khoa Garvan, Úc
Tài liệu tham khảo
1. Anonymous. Consensus development conference: diagnosis, prophylaxis, and treatment of osteoporosis. Am J Med. 1993;94(6):646-50.
2. Nguyen ND, Pongchaiyakul C, Center JR, Eisman JA, Nguyen TV. Identification of high-risk individuals for hip fracture: a 14-year prospective study. J Bone Miner Res. 2005;20(11):1921-8.
3. Center JR, Nguyen TV, Schneider D, Sambrook PN, Eisman JA. Mortality after all major types of osteoporotic fracture in men and women: an observational study. Lancet. 1999;353(9156):878-82.
4. Ray NF, Chan JK, Thamer M, Melton LJ, 3rd. Medical expenditures for the treatment of osteoporotic fractures in the United States in 1995: report from the National Osteoporosis Foundation. J Bone Miner Res. 1997;12(1):24-35.
5. Ho-Pham LT, Nguyen UD, Pham HN, Nguyen ND, Nguyen TV. Reference ranges for bone mineral density and prevalence of osteoporosis in Vietnamese men and women. BMC Musculoskelet Disord. 2011;12:182.
6. Looker AC, Melton LJ, 3rd, Harris TB, Borrud LG, Shepherd JA. Prevalence and trends in low femur bone density among older US adults: NHANES 2005-2006 compared with NHANES III. J Bone Miner Res. 2010;25(1):64-71.
7. WHO Study Group. Assessment of fracture risk and its application to screening for post-menopausal osteoporosis. Geneva: WHO; 1994.
8. Michaelsson K, Bergstrom R, Mallmin H, Holmberg L, Wolk A, Ljunghall S. Screening for osteopenia and osteoporosis: selection by body composition. Osteoporos Int. 1996;6(2):120-6.
9. Koh LK, Sedrine WB, Torralba TP, Kung A, Fujiwara S, Chan SP, et al. A simple tool to identify asian women at increased risk of osteoporosis. Osteoporos Int. 2001;12(8):699-705.
10. Pongchaiyakul C, Nguyen ND, Pongchaiyakul C, Nguyen TV. Development and validation of a new clinical risk index for prediction of osteoporosis in Thai women. J Med Assoc Thai. 2004;87(8):910-6.
11. Cadarette SM, Jaglal SB, Kreiger N, McIsaac WJ, Darlington GA, Tu JV. Development and validation of the Osteoporosis Risk Assessment Instrument to facilitate selection of women for bone densitometry. CMAJ. 2000;162(9):1289-94.
12. Lydick E, Cook K, Turpin J, Melton M, Stine R, Byrnes C. Development and validation of a simple questionnaire to facilitate identification of women likely to have low bone density. The American journal of managed care. 1998;4(1):37-48.
13. Sedrine WB, Chevallier T, Zegels B, Kvasz A, Micheletti MC, Gelas B, et al. Development and assessment of the Osteoporosis Index of Risk (OSIRIS) to facilitate selection of women for bone densitometry. Gynecol Endocrinol. 2002;16(3):245-50.
14. Weinstein L, Ullery B. Identification of at-risk women for osteoporosis screening. American journal of obstetrics and gynecology. 2000;183(3):547-9.
15. Shan LP, Bee OF, Suniza SS, Adeeb N. Developing a Malaysian Osteoporosis Screening Tool (MOST) for early osteoporosis detection in Malaysian women. Sex Reprod Healthc. 2011;2(2):77-82.
16. Rud B, Hilden J, Hyldstrup L, Hrobjartsson A. The Osteoporosis Self-Assessment Tool versus alternative tests for selecting postmenopausal women for bone mineral density assessment: a comparative systematic review of accuracy. Osteoporos Int. 2009;20(4):599-607.
17. Rubin KH, Friis-Holmberg T, Hermann AP, Abrahamsen B, Brixen K. Risk assessment tools to identify women with increased risk of osteoporotic fracture: complexity or simplicity? A systematic review. J Bone Miner Res. 2013;28(8):1701-17.
18. Nayak S, Edwards DL, Saleh AA, Greenspan SL. Performance of risk assessment instruments for predicting osteoporotic fracture risk: a systematic review. Osteoporos Int. 2014;25(1):23-49.
19. Nayak S, Edwards DL, Saleh AA, Greenspan SL. Systematic review and meta-analysis of the performance of clinical risk assessment instruments for screening for osteoporosis or low bone density. Osteoporos Int. 2015;26(5):1543-54.
20. Rud B, Hilden J, Hyldstrup L, Hrobjartsson A. Performance of the Osteoporosis Self-Assessment Tool in ruling out low bone mineral density in postmenopausal women: a systematic review. Osteoporos Int. 2007;18(9):1177-87.
21. Kung AW, Ho AY, Sedrine WB, Reginster JY, Ross PD. Comparison of a simple clinical risk index and quantitative bone ultrasound for identifying women at increased risk of osteoporosis. Osteoporos Int. 2003;14(9):716-21.
22. Chan SP, Teo CC, Ng SA, Goh N, Tan C, Deurenberg-Yap M. Validation of various osteoporosis risk indices in elderly Chinese females in Singapore. Osteoporos Int. 2006;17(8):1182-8.
23. Cherian KE, Kapoor N, Shetty S, Naik D, Thomas N, Paul TV. Evaluation of Different Screening Tools for Predicting Femoral Neck Osteoporosis in Rural South Indian Postmenopausal Women. J Clin Densitom. 2018;21(1):119-24.
24. Cadarette SM, Jaglal SB, Murray TM, McIsaac WJ, Joseph L, Brown JP, et al. Evaluation of decision rules for referring women for bone densitometry by dual-energy x-ray absorptiometry. JAMA. 2001;286(1):57-63.
25. Ben Sedrine W, Reginster JY. Risk indices and osteoporosis screening: scope and limits. Mayo Clin Proc. 2002;77(7):622-3.
26. Park HM, Sedrine WB, Reginster JY, Ross PD, Osta. Korean experience with the OSTA risk index for osteoporosis: a validation study. J Clin Densitom. 2003;6(3):247-50.
27. Pongchaiyakul C, Nguyen ND, Eisman JA, Nguyen TV. Clinical risk indices, prediction of osteoporosis, and prevention of fractures: diagnostic consequences and costs. Osteoporos Int. 2005;16(11):1444-50.
28. Li-Yu JT, Llamado LJ, Torralba TP. Validation of OSTA among Filipinos. Osteoporos Int. 2005;16(12):1789-93.
29. Zhang X, Lin J, Yang Y, Wu H, Li Y, Yang X, et al. Comparison of three tools for predicting primary osteoporosis in an elderly male population in Beijing: a cross-sectional study. Clinical interventions in aging. 2018;13:201-9.
30. Ho-Pham LT NT. The Vietnam Osteoporosis Study: Rationale and design. Osteoporosis and Sarcopenia. 2017;2:90-7.
31. Koh LK, Sedrine WB, Torralba TP, Kung A, Fujiwara S, Chan SP, et al. A simple tool to identify asian women at increased risk of osteoporosis. Osteoporos Int. 2001;12(8):699-705.


